เซลล์ไฟฟ้าเคมี แบ่งออกเป็น 2 ประเภทคือ
1. เซลล์กัลวานิก (galvanic cell) หรือเซลล์โวลตาอิก (voltaic cell)
2. เซลล์อิเล็กโทรไลต์ (electrolytic cell)
เซลล์กัลวานิก
ได้กล่าวถึงปฏิกิริยารีดอกซ์ที่เกิดขึ้นเมื่อนำแผ่นสังกะสีจุ่มลงในสารละลายของทองแดง หรือตัวรีดิวซ์จุ่มลงในตัวออกซิไดซ์โดยตรงแล้วในบทนำ ปฏิกิริยาที่เกิดขึ้นทำให้เกิดพลังงานในรูปของความร้อน แต่ถ้าแยกตัวรีดิวซ์ออกจากตัวออกซิไดซ์ แล้วเชื่อมต่อวงจรภายนอกและสะพานเกลือ ( salt bridge) อิเล็กตรอนก็จะถูกถ่ายโอนผ่านตัวกลางภายนอกจากขั้วไฟฟ้าที่เกิดปฏิกิริยาออกซิเดชันไปยังขั้วไฟฟ้าที่เกิดปฏิกิริยารีดักชัน จึงทำให้เกิดกระแสไฟฟ้าได้ เซลล์ไฟฟ้าที่เกิดจากปฏิกิริยาเคมีนี้เรียกว่า เซลล์กัลวานิก หรือเซลล์โวลตาอิก (galvanic cell or voltaic cell) ดังภาพ
จากรูปเซลล์กัลวานิกประกอบด้วยสองครึ่งเซลล์ โดยแต่ละครึ่งเซลล์จะประกอบด้วยขั้วไฟฟ้าที่จุ่มลงไปในสารละลาย แท่งสังกะสีและแท่งทองแดงในเซลล์เป็นขั้วไฟฟ้าซึ่งเรียกว่า อิเล็กโทรด ( electrode ) ขั้วที่เกิดปฏิกิริยาออกซิเดชัน เรียกว่า ขั้วแอโนด ( anode ) และขั้วที่เกิดปฏิกิริยารีดักชัน เรียกว่า ขั้วแคโทด (cathode)
ปฏิกิริยาออกซิเดชันที่แอโนด ( Zn )
Zn
(s )  Zn 2+(aq) + 2e -
Zn 2+(aq) + 2e -
ปฏิกิริยารีดักชันที่แคโทด (Cu )
Cu
2+(aq) + 2e - Cu(s)
Cu(s)
หมายเหตุ : ประจุที่สะสมจะทำให้ออกซิเดชันที่แคโทดและรีดักชันที่แอโนดเกิดยากขึ้น
ระหว่างที่เกิดปฏิกิริยาออกซิเดชันขึ้นที่ขั้วแอโนด Zn จะค่อย ๆ กร่อนแล้วเกิดเป็น Zn 2+ ละลายลงมาในสารละลายที่มี Zn 2+ และ SO 4 2- ส่วนที่ขั้วแคโทด Cu 2+ จากสารละลายเกิดปฏิกิริยารีดักชันกลายเป็นอะตอมของทองแดงเกาะอยู่ที่ผิวของขั้วไฟฟ้า เมื่อปฏิกิริยาดำเนินไปจะพบว่าในครึ่งเซลล์ออกซิเดชันสารละลายจะมีประจุบวก (Zn 2+) มากกว่าประจุลบ (SO 4 2-) และในครึ่งเซลล์รีดักชันสารละลายจะมีประจุลบ (SO 4 2-) มากกว่าประจุบวก (Cu 2+) จึงเกิดความไม่สมดุลทางไฟฟ้าขึ้น ปัญหานี้สามารถที่จะแก้ไขได้โดยการใช้ สะพานเกลือ (salt bridge) เชื่อมต่อระหว่างสองครึ่งเซลล์ ซึ่งสะพานเกลือทำจากหลอดแก้วรูปตัวยู ภายในบรรจุอิเล็กโตรไลต์ที่ไม่ทำปฏิกิริยากับสารในเซลล์และมีไอออนบวก ไอออนลบเคลื่อนที่ด้วยความเร็วใกล้เคียงกัน หรือทำจากกระดาษกรองชุบอิเล็กโตรไลต์ โดยสะพานเกลือทำหน้าที่เป็นตัวกลางที่เชื่อมต่อระหว่างครึ่งเซลล์ทั้งสอง และเป็นสิ่งที่ป้องกันการเกิดการสะสมของประจุโดยไอออนบวกจากสะพานเกลือจะเคลื่อนที่ไปยังครึ่งเซลล์ที่มีประจุลบมาก ในทางตรงกันข้ามไอออนลบก็จะเคลื่อนที่ไปยังครึ่งเซลล์ที่มีประจุมาก จึงทำให้ปฏิกิริยาดำเนินต่อไปได้ในเวลาที่มากขึ้น
และเนื่องจากครึ่งเซลล์ทั้งสองเชื่อมต่อกับวงจรภายนอก ครึ่งเซลล์ที่มีศักย์รีดักชันสูงกว่าจะเกิดรีดักชัน และครึ่งเซลล์ที่มีศักย์รีดักชันต่ำกว่าจะ(ถูกบังคับให้)เกิดออกซิเดชัน ความต่างศักย์ระหว่างอิเล็กโทรดนี้ เรียกว่า แรงเคลื่อนไฟฟ้า (electromotive force: emf) และมีหน่วยเป็น โวลต์ (volt)
เซลล์กัลวานิกแบ่งออกได้เป็น 2 ชนิด
1. เซลล์ปฐมภูมิ (Primary cell) เมื่อปฏิกิริยาเคมีภายในเซลล์เกิดขึ้นและดำเนินไปแล้ว ปฏิกิริยาจะเกิดขึ้นอย่างสมบูรณ์และเกิดปฏิกิริยาย้อนกลับไม่ได้หรือนำมาอัดไฟใหม่ไม่ได้
2 เซลล์ทุติยภูมิ (Secondary cell) เกิดปฏิกิริยาย้อนกลับได้หรือนำมาอัดไฟใหม่ได้
ศักย์ไฟฟ้าอิเล็กโทดมาตรฐาน
จากเซลล์ไฟฟ้า Zn -Cu เมื่อใช้ความเข้มข้นของไอออนของสารละลายในแต่ละครึ่งเซลล์เท่ากับ 1.0 M ที่ 25 ๐C เซลล์ไฟฟ้านี้จะมี emf เท่ากับ 1.10 V ถ้าทราบศักย์ไฟฟ้าของอิเล็กโทรดใดอิเล็กโทรดหนึ่งแล้วนำไปลบออกจาก 1.10 V ก็จะทราบค่าของอิเล็กโทรดหนึ่ง แต่ในทางปฏิบัติไม่สามารถวัดศักย์ไฟฟ้าของอิเล็กโทรดเดี่ยว ๆ ได้ จึงได้มีการกำหนดอิเล็กโทรดมาตรฐานขึ้นมา ซึ่งได้แก่ ไฮโดรเจนอิเล็กโทรดมาตรฐาน (Standard Hydrogen Electrode : SHE) ในครึ่งเซลล์ไฮโดรเจนมาตรฐานนี้ประกอบด้วย ขั้วแพลตินัม (อิเล็กโทรดเฉื่อย) สารละลายกรดไฮโดรคลอริก และก๊าซไฮโดรเจนภายใต้ สภาวะมาตรฐาน ( ความดันของก๊าซไฮโดรเจนเท่ากับ 1 atm ความเข้มข้นของสารละลายกรดไฮโดรคลอริกเท่ากับ 1 M และวัดที่อุณหภูมิ 25 ๐C) โดยผ่านก๊าซไฮโดรเจนในสารละลายกรดไฮโดรคลอริกตลอดเวลา จึงมีสมดุลเกิดขึ้นดังสมการ
2H +(aq) + 2e - H 2(g)
H 2(g)
ค่าศักย์มาตรฐานของครึ่งเซลล์ไฮโดรเจนมาตรฐานเท่ากับ 0.00 V ใช้สัญลักษณ์ E ๐ แทนศักย์ไฟฟ้าที่สภาวะมาตรฐาน
หมายเหตุ : ครึ่งเซลล์เป็นเหมือนอิเล็กโทรดหรือขั้ว
สามารถใช้ครึ่งเซลล์ไฮโดรเจนมาตรฐานนี้ในการหาศักย์ไฟฟ้าของอิเล็กโทรดอื่น เช่น เมื่อต่อเซลล์กัลวานิก ระหว่างครึ่งเซลล์ SHE และครึ่งเซลล์ Cu ดังรูป
จากโวลต์มิเตอร์ได้ค่าศักย์ไฟฟ้ามาตรฐานของเซลล์เท่ากับ 0.34 V โดยมีปฏิกิริยาเกิดขึ้นดังนี้
ปฏิกิริยาออกซิเดชันที่แอโนด (SHE ) H 2(g) -----------> 2H +(aq) + 2e -
ปฏิกิริยารีดักชันที่แคโทด (Cu ) Cu 2+(aq) + 2e - -----------> Cu(s)
จาก E ๐ cell = E ๐ cathode - E ๐ anode
ดังนั้น E ๐ cell = E ๐ Cu - E ๐ SHE
0.34 V = E ๐ Cu - 0.00 V
E ๐ Cu = 0.34 V - 0.00 V = 0.34 V
เมื่อต่อเซลล์กัลวานิกระหว่างครึ่งเซลล์ SHE และครึ่งเซลล์ Zn จะได้เป็น

อ่านค่าศักย์ไฟฟ้ามาตรฐานของเซลล์ได้เท่ากับ 0.76 V โดยมีปฏิกิริยาเกิดขึ้น ดังสมการ
ปฏิกิริยาออกซิเดชันที่แอโนด (Zn )
Zn
(s ) Zn 2+(aq) + 2e -
Zn 2+(aq) + 2e -
ปฏิกิริยารีดักชันที่แคโทด (SHE )
2H +(aq) + 2e - H 2(g)
H 2(g)
จาก
E ๐ cell =
E ๐ cathode - E ๐ anode
ดังนั้น E
๐ cell
=
E ๐ SHE - E ๐ Zn
0.76
V = 0.00 V - E ๐ Zn
E
๐ Zn
=
0.00 V – 0.76 V = -0.76 V
ค่า E ๐
ที่ได้เป็นค่าศักย์รีดักชันของแต่ละครึ่งเซลล์ นั่นคือ
Cu
2+(aq) + 2e - Cu(s) E ๐ = +0.34
V
Cu(s) E ๐ = +0.34
V
Zn
2+(aq) + 2e -  Zn(s) E ๐ = -0.76
V
Zn(s) E ๐ = -0.76
V
*** ค่า E ๐ เป็นค่าศักย์ไฟฟ้ามาตรฐานของปฏิกิริยารีดักชัน
*** ค่า E ๐ เป็นบวกมาก แสดงว่าตัวออกซิไดซ์ (ด้านซ้ายของสมการ) จะเป็นตัวออกซิไดซ์ที่แรง ส่วนตัวรีดิวซ์ (ด้านขวาของสมการ) จะเป็นตัวรีดิวซ์ที่อ่อน ดังนั้นสารที่อยู่ทางซ้ายของครึ่งปฏิกิริยาใด ๆ จะทำปฏิกิริยาได้เองกับสารที่อยู่ทางขวาของครึ่งปฏิกิริยาที่อยู่ถัดลงมา เช่น
Br 2(l) + 2Ag(s)

2Br -(aq) + 2Ag +aq)
*** การเปลี่ยนสัมประสิทธิ์ของปฏิกิริยาครึ่งเซลล์ไม่มีผลต่อค่า E ๐
*** เมื่อกลับทิศทางของปฏิกิริยาเป็นปฏิกิริยาออกซิเดชัน ค่า E ๐ จะมีเครื่องหมายตรงข้าม
*** ปฏิกิริยารีดอกซ์ที่เกิดขึ้นได้เอง จะต้องมีค่า E ๐ ของเซลล์เป็นบวกเสมอ
ตัวอย่าง 1 2Ag +(aq) + Mg(s)

2Ag(s) + Mg 2+(aq)
จาก E ๐ cell = E ๐ cathode - E ๐ anode
= +0.80 V - (-2.37 V) = +3.17 V
ดังนั้น ปฏิกิริยานี้เกิดขึ้นได้เอง
ตัวอย่าง 2 Fe 2+(aq) + Ni(s)

Fe(s) + Ni 2+(aq)
จาก E ๐ cell = E ๐ cathode - E ๐ anode
= -0.44 V - (-0.25 V) = -0.19 V
ดังนั้น ปฏิกิริยานี้เกิดขึ้นเองไม่ได้ ปฏิกิริยาที่เกิดขึ้นได้เองคือ
Fe(s) + Ni 2+(aq)

Fe 2+(aq) + Ni(s)
จากตารางค่าศักย์ไฟฟ้ารีดักชันมาตรฐานและตารางธาตุให้ความสอดคล้องที่สำคัญคือ ธาตุที่เป็นโลหะมีความสามารถในการให้อิเล็กตรอนที่ดี สังเกตได้จากการที่โลหะมีค่า E ๐ ต่ำ มีข้อยกเว้นเพียงโลหะ 4 ชนิด ซึ่งได้แก่ ทองคำ แพลตินัม ทองแดง และเงินเท่านั้น ที่มีความสามารถในการให้อิเล็กตรอนไม่ดี

ตารางค่าศักย์ไฟฟ้ารีดักชันมาตรฐานและตารางธาตุไม่ได้ให้ความสอดคล้องของความเป็นโลหะกับค่า E ๐ ทั้งหมด ถ้าพิจารณาให้ดี ธาตุที่มีความเป็นโลหะมากที่สุดควรจะอยู่มุมล่างซ้ายสุดของตารางธาตุ และควรเป็นธาตุที่มีความสามารถให้อิเล็กตรอนได้ดีที่สุด ( พิจารณาจากแนวโน้มของค่าพลังงานไอออไนเซชัน ซึ่งมีแนวโน้มลดลงจากบนลงล่าง) แต่จากค่าตารางค่าศักย์ไฟฟ้ารีดักชันมาตรฐาน Li มี E ๐ ต่ำที่สุด นั่นแสดงว่า Li มีความสามารถให้อิเล็กตรอนได้ดีที่สุด สาเหตุของความไม่สอดคล้องกันนี้ก็คือ พลังงานไอออไนเซชันเป็นค่าที่วัดจากการที่อะตอมให้อิเล็กตรอนเมื่ออยู่ในสภาวะก๊าซ (M(g)

M +(g) + e -) แต่ศักย์ไฟฟ้ามาตรฐานเป็นค่าที่วัดจากการที่อะตอมในสภาวะของแข็งเสียอิเล็กตรอนเกิดเป็นไอออนบวกในน้ำ (M(s)

M +(aq) + e -) เนื่องจาก Li + มีขนาดเล็ก อัตราส่วนของประจุต่อรัศมีไอออนมีค่าสูง เมื่อ Li + อยู่ในน้ำจะเกิดแรงดึงดูดอย่างแรงกับน้ำ จึงมีความสามารถให้อิเล็กตรอนแล้วเกิดเป็นไอออนได้ดีกว่าโลหะตัวอื่น

การเขียนแผนภาพของเซลล์กัลวานิกมีหลักดังนี้
1. เขียนครึ่งเซลล์ที่เกิดปฏิกิริยาออกซิเดชันไว้ทางซ้ายมือ โดยเขียนขั้วไฟฟ้าไว้ทางซ้ายสุด ตามด้วยไอออนในสารละลาย และใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับไอออนในสารละลาย เช่น Zn(s)/Zn 2+(aq)
2. เขียนครึ่งเซลล์เซลล์ที่เกิดปฏิกิริยารีดักชันไว้ทางขวามือ โดยเขียนไอออนในสารละลายก่อน ตามด้วยขั้วไฟฟ้าไว้ทางขวาสุด และใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับไอออนในสารละลาย เช่น Cu 2+(aq)/Cu(s)
3. สำหรับครึ่งเซลล์ที่ประกอบด้วยโลหะกับก๊าซ ใช้เส้นเดี่ยว / ขีดคั่นระหว่างขั้วไฟฟ้ากับก๊าซและระหว่างไอออนในสารละลาย เช่น Pt(s)/H 2(g,1 atm)/H +(aq)
4. เขียนเส้นคู่ขนาน // แทนสะพานไอออนกั้นระหว่างครึ่งเซลล์ทั้งสอง เช่น
Zn(s)/Zn 2+(aq)// Cu 2+(aq)/Cu(s)
Pt(s)/H 2(g,1 atm)/H +(1 mol/dm 3)// Cu 2+(1 mol/dm 3)/Cu(s)
5. สำหรับครึ่งเซลล์ที่มีสารสถานะเดียวกันมากกว่าหนึ่งชนิด ให้ใช้เครื่องหมายจุลภาคคั่นระหว่างไอออนทั้งสอง เช่น
Fe(s)/Fe 2+(aq),Fe 3+(aq)// Cu 2+(aq)/Cu(s)
เซลล์ปฐมภูมิมีหลายชนิด เช่น
1. เซลล์แห้ง (Dry Cell ) หรือเซลล์เลอคลังเช (LeClanche Cell)
เซลล์ไฟฟ้าชนิดนี้ถูกเรียกว่า เซลล์แห้ง เพราะไม่ได้ใช้ของเหลวเป็นอิเล็กโทรไลต์ เป็นเซลล์ที่ใช้ในไฟฉาย หรือใช้ในประโยชน์อื่น ๆ เช่น ในวิทยุ เครื่องคิดเลข ฯลฯ ซึ่งมีลักษณะตามรูป
ส่วนประกอบของเซลล์แห้ง
กล่องของเซลล์ทำด้วยโลหะสังกะสีซึ่งทำหน้าที่เป็นขั้วแอโนด (ขั้วลบ) ส่วนแท่งคาร์บอนหรือแกรไฟต์อยู่ตรงกลางทำหน้าที่เป็นขั้วแคโทด (ขั้วบวก) ระหว่างอิเล็กโตรดทั้งสองบรรจุด้วยของผสมชื้นของแอมโมเนียมคลอไรด์ (NH 4Cl) แมงกานีส (IV ) ออกไซด์ (MnO 2) ซิงค์คลอไรด์ (ZnCl 2) ผงคาร์บอน ตอนบนของเซลล์ผนึกด้วยวัสดุที่สามารถรักษาความชื้นภายในเซลล์ให้คงที่ มีปฏิกิริยาเกิดขึ้นดังนี้
ที่ขั้วแอโนด (Zn -ขั้วลบ) Zn ถูกออกซิไดซ์กลายเป็น Zn 2+
Zn(s)

Zn 2+(aq) + 2e -
ที่ขั้วแคโทด (C -ขั้วบวก) MnO 2 จะถูกรีดิวซ์ ไปเป็น Mn 2O 3
2MnO 2(s) + 2NH 4 ++(aq) + 2e -

Mn 2O 3(s) + H 4O(l)
ดังนั้นปฏิกิริยารวมจึงเป็น
Zn(s) + 2MnO 2(s) + 2NH 4 +(aq)

Zn 2+(aq) + Mn 2O 3(s) + 2NH 3(g) + H 2O(l)
แก๊ส NH 3 ที่เกิดขึ้นจะเข้าทำปฏิกิริยากับ Zn 2+ เกิดเป็นไอออนเชิงซ้อนของ [Zn (NH 3) 4] 2+ และ [Zn(NH 3) 2(H 2O) 2] 2+ การเกิดไอออนเชิงซ้อนนี้จะช่วยรักษาความเข้มข้นของ Zn 2+ ไม่ให้สูงขึ้น จึงทำให้ศักย์ไฟฟ้าของเซลล์เกือบคงที่เป็นเวลานานพอสมควร จากปฏิกิริยารวมจะสังเกตว่ามีน้ำเป็นผลิตภัณฑ์ด้วย ดังนั้นเซลล์ที่เสื่อมสภาพจึงบวมและมีน้ำไหลออกมา และเซลล์แห้งนี้จะให้ศักย์ไฟฟ้าประมาณ 1.5 โวลต์
2. เซลล์แอลคาไลน์ (Alkaline Cell )
เซลล์แอลคาไลน์มีส่วนประกอบของเซลล์เหมือนกับเซลล์เลอคลังเช แต่มีสิ่งที่แตกต่างกันคือเซลล์แอลคาไลน์ใช้ เบสซึ่งได้แก่โพแตสเซียมไฮดรอกไซด์ (KOH ) เป็นอิเล็กโทรไลต์แทนแอมโมเนียมคลอไรด์ (NH 4Cl) และเนื่องจากใช้สารละลายเบสนี่เองเซลล์ชนิดนี้จึงถูกเรียกว่า เซลล์แอลคาไลน์
ที่ขั้วแอโนด (Zn -ขั้วลบ) Zn ถูกออกซิไดซ์
Zn(s) + 2OH -(aq)

ZnO(s) + H 2O(l) + 2e -
ที่ขั้วแคโทด (C -ขั้วบวก) MnO 2 จะถูกรีดิวซ์ ไปเป็น Mn 2O 3
2MnO 2(s) + H 2O(l) + 2e -

Mn 2O 3(s) + 2OH -(aq)
สมการรวม Zn (s ) + 2MnO 2(s)

ZnO(s) + Mn 2O 3(s)
เซลล์นี้จะให้ศักย์ไฟฟ้าประมาณ 1.5 โวลต์ แต่ให้กระแสไฟฟ้าได้มากกว่าและนานกว่าเซลล์แห้ง เพราะ OH - ที่เกิดขึ้นที่ขั้วคาร์บอนสามารถนำกลับไปใช้ที่ขั้วสังกะสีได้
3. เซลล์ปรอท (Mercury Cell )
มีหลักการเช่นเดียวกับเซลล์แอลคาไลน์ แต่ใช้เมอร์คิวรี (II ) ออกไซด์ (HgO ) แทนแมงกานีส (IV ) ออกไซด์ (MnO 2) เป็นเซลล์ที่มีขนาดเล็กใช้กันมากในเครื่องฟังเสียงสำหรับคนหูพิการ หรือใช้ในอุปกรณ์อื่น เช่น นาฬิกาข้อมือ เครื่องคิดเลข เซลล์นี้จะให้ศักย์ไฟฟ้าประมาณ 1.3 โวลต์ ให้กระแสไฟฟ้าต่ำ แต่สามารถให้ค่าศักย์ไฟฟ้าคงที่ตลอดอายุการใช้งาน มีปฏิกิริยาเคมีดังนี้
ที่ขั้วแอโนด Zn (s ) + 2OH -(aq)

ZnO(s) + H 2O(l) + 2e -
ที่ขั้วแคโทด HgO (s ) + H 2O(l) + 2e -

Hg(l) + 2OH -(aq)
ปฏิกิริยารวม Zn (s ) + HgO (s )

ZnO(s) + Hg(l)
เซลล์ทุติยภูมิมีหลายชนิด เช่น
1. แบตเตอรี่สะสมไฟฟ้าแบบตะกั่ว ( Lead Storage Battery)
แบตเตอรี่คือเซลล์ไฟฟ้าหลาย ๆ เซลล์ต่อกันเป็นอนุกรม แบตเตอรี่สะสมไฟฟ้าแบบตะกั่วนี้เป็นแบตเตอรีที่ใช้ในรถยนต์ โดยประกอบด้วยเซลล์ไฟฟ้า 6 เซลล์ แต่ละเซลล์จะมีศักย์ไฟฟ้า 2 โวลต์ ดังนั้นแบตเตอรี่ในรถยนต์มีศักย์ไฟฟ้า 12 โวลต์
ส่วนประกอบของแบตเตอรี่สะสมไฟฟ้าแบบตะกั่ว

เซลล์สะสมไฟฟ้าแบบตะกั่ว
1) เมื่ออัดไฟครั้งแรก
2) เมื่อจ่ายไฟ
3) เมื่ออัดไฟครั้งต่อไป
แบตเตอรี่สะสมไฟฟ้าแบบตะกั่วจะประกอบด้วยอิเล็กโทรดคือแผ่นตะกั่ว
มีกรดซัลฟิวริกเจือจางเป็นอิเล็กโทรไลต์
เมื่อมีการอัดไฟครั้งแรกแผ่นตะกั่วที่ต่อกับขั้วบวกของแบตเตอรี (ขั้วแอโนด)
จะถูกออกซิไดซ์เป็นเลด (II ) ไอออน ดังสมการ
Pb(s)  Pb 2+(aq) + 2e -
Pb 2+(aq) + 2e -
เมื่อรวมกับออกซิเจนที่เกิดขึ้นจะกลายเป็นเลด
(IV ) ออกไซด์
Pb
2+(aq) + O 2(g)  PbO 2(s)
PbO 2(s)
ดังนั้นที่ขั้วแอโนด (ขั้วบวก) แผ่นตะกั่วจะถูกเปลี่ยนเป็นเลด (IV
) ออกไซด์ขั้วไฟฟ้าจึงแตกต่างกัน (ขั้วแอโนด-ขั้วบวก: PbO 2 และขั้วแคโทด-ขั้วลบ: Pb) ทำให้สามารถเกิดกระแสไฟฟ้าได้หรือจ่ายไฟได้นั่นเอง
การจ่ายไฟเกิดขึ้น ดังสมการ
ขั้วแอโนด-ขั้วลบ: Pb
(s ) + SO 4 2-(aq) PbSO 4(s) + 2e -
PbSO 4(s) + 2e -
ขั้วแคโทด-ขั้วบวก: PbO 2(s)
+ SO 4 2-(aq) + 4H +(aq) + 2e - PbSO 4(s) + 2H 2O(l)
PbSO 4(s) + 2H 2O(l)
อิเล็กตรอนจะเคลื่อนที่จากขั้วแอโนดหรือขั้วลบผ่านวงจรภายนอกไปยังขั้วแคโทดหรือขั้วบวก
จากสมการจะสังเกตได้ว่ามีผลิตภัณฑ์คือ PbSO 4(s) เกิดขึ้นเหมือนกัน
ดังนั้นเมื่อใช้แบตเตอรี่ไประยะหนึ่งความต่างศักย์จะลดลง และจะลดลงไปเรื่อย ๆ
จนกระทั่งเป็นศูนย์ ทั้งนี้เนื่องจากขั้วไฟฟ้าทั้งคู่เหมือนกัน
จึงไม่มีความแตกต่างของศักย์ไฟฟ้าระหว่างขั้วทั้งสอง
ปฏิกิริยาของเชลล์ข้างบนเป็นผันกลับได้
ดังนั้นถ้าต้องการให้เกิดการผันกลับจึงจำเป็นต้องมีการอัดไฟฟ้าใหม่
โดยการต่อขั้วบวกของเซลล์กับขั้วบวกของแบตเตอรี่และขั้วลบกับขั้วลบของแบตเตอรี่
ปฏิกิริยาข้างบนก็จะเปลี่ยนทิศทางเป็นจากขวาไปซ้าย ในลักษณะนี้เลด(II ) ซัลเฟตที่ขั้วลบก็จะเปลี่ยนเป็นตะกั่ว ส่วนอีกขั้วหนึ่ง เลด (II ) ซัลเฟตจะเปลี่ยนเป็นเลด (IV ) ออกไซด์ ดังสมการ
ขั้วแอโนด-ขั้วบวก: PbSO 4(s) + 2H 2O(l) PbO
2(s) + SO 4 2-(aq) + 4H +(aq) + 2e -
PbO
2(s) + SO 4 2-(aq) + 4H +(aq) + 2e -
ขั้วแคโทด-ขั้วลบ: PbSO 4(s) + 2e - Pb(s) + SO 4 2-(aq)
Pb(s) + SO 4 2-(aq)
จากปฏิกิริยาในขณะที่มีการจ่ายไฟฟ้า
ความเข้มข้นของกรดจะลดลงเรื่อย ๆ จากปกติที่มีความถ่วงจำเพาะ ประมาณ 1.25 ถึง 1.30 แล้วแต่อุณหภูมิในขณะนั้น ๆ ถ้าหากเมื่อใดมีความถ่วงจำเพาะต่ำกว่า
1.20 ที่อุณหภูมิของห้องก็ควรจะมีการอัดไฟฟ้าใหม่ได้
2. ซลล์นิกเกิล-แคดเมียม หรือเซลล์นิแคด (Nickel-Cadmium
Cell)

ที่ขั้วแอโนด: Cd(s) + 2OH -(aq)

Cd(OH) 2(s) + 2e -
ที่ขั้วแคโทด: NiO 2(s) + 2H 2O(l) + 2e -

Ni(OH) 2(s) + 2OH -(aq)
ปฏิกิริยารวม: Cd(s) + NiO 2(s) + 2H 2O(l)

Cd(OH) 2(s) + Ni(OH) 2(s)
3. เซลล์ลิเทียมไอออน ( Lithium Ion Cell)
เซลล์ลิเทียมอาจให้ศักย์ไฟฟ้าสูงถึง 3 โวลต์ เป็นเซลล์ที่ใช้อิเล็กโทรไลต์เป็นของแข็งได้แก่สารพอลิเมอร์ที่ยอมให้ไอออนผ่านแต่ไม่ยอมให้อิเล็กตรอนผ่าน ขั้วแอโนดคือลิเทียมซึ่งเป็นธาตุที่มีค่าศักย์ไฟฟ้ารีดักชันมาตรฐานต่ำที่สุด มีความสามารถในการให้อิเล็กตรอนได้ดีที่สุด ส่วนแคโทดใช้สารที่เรียกว่าสารประกอบแทรกชั้น (Insertion Compound ) ได้แก่ TiS 2 หรือ V 6O 13
เซลล์อิเล็กโทรไลต์
เมื่อผ่านไฟฟ้าเข้าไปในเซลล์ที่ประกอบด้วยขั้วไฟฟ้าสองขั้วจุ่มอยู่ในสารละลายอิเล็กโทรไลต์ จะเกิดปฏิกิริยาเกิดขึ้นภายในเซลล์ เรียกกระบวนการนี้ว่า อิเล็กโทรลิซิส ( electrolysis ) และเรียกเซลล์ไฟฟ้าเคมีนี้ว่า เซลล์อิเล็กโทรไลต ์ ดังรูป
ในการพิจารณาขั้วบวก/ขั้วลบจะพิจารณาจากปริมาณอิเล็กตรอนว่ามีมากหรือน้อย
- เซลล์แกลแวนิก ขั้วที่เกิดออกซิเดชันมีอิเล็กตรอนสะสม(จากภายใน) จึงเป็นขั้วลบ
- เซลล์แกลแวนิก ขั้วที่เกิดรีดักชันมีอิเล็กตรอนสะสม(จากภายนอก) จึงเป็นขั้วลบ
ในเมื่อแบตเตอรี่เป็นตัวจ่ายกระแสไฟฟ้า อิเล็กตรอนจะเคลื่อนที่ออกจากขั้วแอโนด (ขั้วลบ) ของแบตเตอรี่ผ่านลวดตัวนำไปยังขั้วไฟฟ้าของเซลล์อิเล็กโทรไลต์ ดังนั้นขั้วไฟฟ้าที่ต่อกับขั้วลบของแบตเตอรี่จะเป็นขั้วแคโทด เพราะเป็นขั้วที่เกิดปฏิกิริยารีดักชัน และเนื่องจากต่อกับขั้วลบ ขั้วไฟฟ้านี้จึงเป็นขั้วลบ ส่วนขั้วไฟฟ้าอีกขั้วหนึ่งเกิดปฏิกิริยาออกซิเดชันจึงเป็นขั้วแอโนด และต่อกับขั้วบวกของแบตเตอรี่จึงเป็นขั้วบวก อิเล็กตรอนเคลื่อนที่ออกจากขั้วแอโนดของเซลล์เข้าสู่แบตเตอรี่
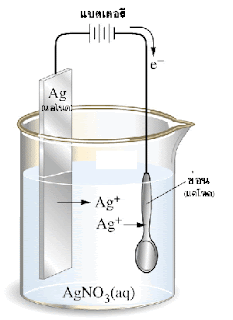
ประโยชน์ของเซลล์อิเล็กโทรไลต์
การชุบโลหะ
การชุบช้อนโลหะด้วยเงิน
หลักการของการชุบโลหะด้วยไฟฟ้า คือ ต้องให้โลหะชนิดหนึ่งมาเคลือบบนโลหะอีกชนิดหนึ่งที่อยู่เป็นแคโทด โดยจัดเซลล์ดังนี้ขั้วแอโนด: โลหะที่ใช้ชุบ
ขั้วแคโทด: โลหะที่ต้องการชุบ
สารละลายอิเล็กโทรไลต์: โลหะไอออนของโลหะที่เป็นแอโนด
ไฟฟ้า: กระแสตรง
|
เซลล์แกลแวนิกและเซลล์อิเล็กโทรไลต์
เซลล์แกลแวนิก
|
เซลล์อิเล็กโทรไลต ์
|
| 1. จากปฏิกิริยาเคมีเป็นพลังงานไฟฟ้า | 1. จากพลังงานไฟฟ้าเป็นปฏิกิริยาเคมี |
| 2. เป็นปฏิกิริยาที่สามารถเกิดขึ้นได้เอง | 2. เป็นปฏิกิริยาที่ไม่สามารถเกิดขึ้นได้เอง ต้องใช้พลังงานไฟฟ้าทำให้เกิดปฏิกิริยา |
| 3. ค่าศักย์ไฟฟ้าของเซลล์เป็นบวกเสมอ | 3. ค่าศักย์ไฟฟ้าของเซลล์เป็นลบ |
4. ขั้วแอโนดเกิดปฏิกิริยาออกซิเดชันเป็นขั้วลบ
ขั้วแคโทดเกิดปฏิกิริยารีดักชันเป็นขั้วบวก | 4. ขั้วแอโนดเกิดปฏิกิริยาออกซิเดชันเป็นขั้วบวก
ขั้วแคโทดเกิดปฏิกิริยารีดักชันเป็นขั้วลบ |
การกัดกร่อนของโลหะ
มี 2 ประเภท
การผุกร่อนของโลหะคือการที่โลหะทาปฏิกิริยากับสารต่างๆ ในสิ่งแวดล้อมรอบๆ
แล้วทาให้โลหะนั้นเปลี่ยนสภาพไปเป็นสารประกอบประเภทออกไซด์หรือไฮดรอกไซด์
หรือเรียกง่ายๆว่า เนื้อโลหะสูญเสียไป
ปัจจัยที่สำคัญที่ทำให้เกิดการผุกร่อนของโลหะ
ลักษณะการผุกร่อนของโลหะ
หลักการการผุกร่อน
การกัดกร่อนของโลหะ และการป้องกัน
1.กร่อนด้วยปฏิกิริยาเคมีโดยตรง (direct chemical corrosion)
เกิดปฏิกิริยาเคมีโดยตรง ระหว่างผิวโลหะและgas
มักเกิดที่อุณหภูมิสูง
สารประกอบที่เกิดขึ้นจากปฏิกิริยาเหล่านี้ ถ้ามีลักษณะปกคลุมผิวโลหะอย่างเหนียวแน่น และไม่มีรูพรุนจะทำให้ปฏิกิริยาหยุดได้ และจะเป็นตัวป้องกันผิวโลหะไว้อีกชั้นหนึ่ง
2. เกิดการผุกร่อนด้วยปฏิกิริยาไฟฟ้าเคมี (electro–chemical corrosion)
บรรยากาศที่ชื้นหรือของเหลวใดๆ ที่โลหะสัมผัสอยู่ คือ electrolyte
เกิดการเคลื่อนที่ของอิเล็กตรอนจากโลหะที่ผุกร่อนซึ่งเรียกว่า anode ไปยังโลหะหรือ ธาตุซึ่ง anode สัมผัสอยู่
ขึ้นอยู่กับโลหะ
ขึ้นอยู่กับตำแหน่งของโลหะใน electro-chemical series
ขึ้นอยู่กับโลหะอีกชนิดหนึ่งที่สัมผัสอยู่
ขึ้นกับโครงสร้างของเนื้อโลหะนั้น
ขึ้นอยู่กับความเครียดภายในเนื้อโลหะ
ขึ้นอยู่กับสภาวะแวดล้อม
ความชื้นสัมพัทธ์
ขึ้นกับมลภาวะของบรรยากาศ
ขึ้นกับการกระจายตัวของออกซิเจน
ขึ้นกับอัตราการไหลของของเหลว
ขึ้นกับความเป็นกรด
ขึ้นอยู่กับความเครียดที่เนื้อโลหะได้รับ
การกัดกร่อนแบบสม่ำเสมอ (Uniform Corrosion)
การกัดกร่อนเนื่องจากความต่างศักย์ (Galvanic Corrosion)
การกัดกร่อนแบบช่องแคบ (Crevice Corrosion)
การกัดกร่อนแบบเป็นหลุม (Pitting)
การกัดกร่อนตามขอบเกรน (Intergranular Corrosion)
การผุกร่อนแบบเลือก (Selective Leaching or Dealloying)
การกัดเซาะ (Erosion Corrosion)
Stress corrosion
การป้องกัน
. ทาผิวหน้าของโลหะด้วยสี หรือน้ำมันหรือเคลือบด้วยพลาสติก หรือทาด้วยสารป้องกันการสึกกร่อนชนิดต่างๆ ที่มีจาหน่าย
เคลือบ หรือเชื่อม หรือพันด้วยโลหะที่เสียอิเล็กตรอนได้ง่ายกว่า
ชุบ หรือเคลือบผิวหน้าของโลหะที่ต้องการป้องกันการผุกร่อนด้วยโลหะอื่น
ทำเป็นโลหะผสม โดยการนำโลหะตั้งแต่ 2 ชนิดขึ้นไปมาหลอมรวมกัน
วิธีอะโนไดซ์ คือ การใช้กระแสไฟฟ้าทำให้ผิวหน้าของโลหะกลายเป็นโลหะออกไซด์
วิธีแคโทดิก เนื่องจากการผุกร่อนของโลหะ
วิธีการรมดำ
บทความที่เกี่ยวข้อง
ไม่เฉพาะอาหารที่เราหยิบใส่ปากในแต่ละวันเท่านั้น ที่อาจจะมีความเสี่ยงต่อสุขภาพ แต่ “ภาชนะ” ที่ใส่หรือใช้ปรุงอาหารก็เป็นอีกส่วนหนึ่งที่ทำให้เกิดอันตรายต่อสุขภาพได้เช่นเดียวกัน
ปัจจุบันภาชนะและเครื่องใช้ เหล็กกล้าไร้สนิม (STAINLESS STEEL) เป็นที่นิยมใช้กันอย่างกว้างขวางทั้งในระดับครัวเรือนและอุตสาหกรรม มีการผลิตเพื่อจำหน่ายอย่างแพร่หลาย ในขณะที่ประชาชนอาจจะยังมีความรู้ในเรื่องของภาชนะที่ทำจากเหล็กกล้าไร้สนิมไม่มากนัก
เหล็กกล้าไร้สนิม หรือที่นิยมเรียกทับศัพท์ว่า ‘สเตนเลส สตีล’ นั้น เป็นเหล็กกล้าที่มีการเติมธาตุโครเมียมลงในส่วนผสมไม่น้อยกว่า 10% เพื่อให้เหล็ก กล้ามีสมบัติทนต่อการกัดกร่อนได้ดี โดยโครเมียมที่เติมลงไปในเนื้อของเหล็กจะทำปฏิกิริยากับออกซิเจนในอากาศเกิดเป็นฟิล์มบางๆซึ่งเป็นชั้นของโครเมียมออกไซด์เคลือบผิวโลหะเอาไว้ ไม่ให้น้ำและอากาศผ่านเข้าไปทำลายเนื้อโลหะจนเกิดการกัดกร่อนขึ้นได้ และชั้นฟิล์มนี้ยังสามารถสร้างขึ้นใหม่ได้อย่างรวดเร็วเมื่อผิวโลหะเกิดการขูดขีดอีกด้วย ด้วยความแข็งแรงและทนต่อการกัดกร่อนของเหล็กกล้าไร้สนิมนี่เอง ทำให้ได้รับความนิยมนำไปผลิตเป็นวัสดุหลักที่สำคัญโดยเฉพาะเป็นภาชนะสำหรับปรุงหรือรับประทานอาหาร ซึ่งถือว่าเป็นอุปกรณ์ที่ใกล้ชิดกับชีวิตประจำวันของผู้คนมากที่สุด
ก่อนหน้านี้เคยมีข่าวเกี่ยวกับหม้อก๋วยเตี๋ยวที่ผลิตจากเหล็กกล้าไร้สนิมชนิดออสเตนิติก 304 หรือ 304L ที่นำมาม้วนขึ้นรูป พับตะเข็บรอยต่อและประสานตะเข็บรอยต่อ ป้องกันการรั่วซึมด้วยกระบวนการบัดกรีอ่อน โดยใช้วัสดุบัดกรีที่มีส่วนผสมของตะกั่วและดีบุก ซึ่งต่อมามีการตรวจสอบโดยกรมอนามัย พบว่าตะกั่วที่ใช้บัดกรีในหม้อก๋วยเตี๋ยวสามารถปนเปื้อนกับน้ำลวกเส้นก๋วยเตี๋ยว และน้ำซุปก๋วยเตี๋ยวได้ เมื่อรับประทานก๋วยเตี๋ยวจากหม้อดังกล่าวจึงอาจมีความเสี่ยงต่อการรับสารตะกั่วเข้าสู่ร่างกาย ทำให้มีอาการคลื่นไส้ อาเจียน ท้องเสีย ปวดท้อง เมื่อพิษสะสมจะทำให้ระบบประสาทส่วนปลายเป็นอัมพาตที่นิ้วเท้าและมือ เหนื่อยง่าย และอ่อนเพลียได้
สำนักงานคณะกรรมการคุ้มครองผู้บริโภค (สคบ.) จึงได้ออกประกาศคำสั่งห้ามใช้หม้อก๋วยเตี๋ยว หม้อต้มกาแฟโบราณ ที่ใช้สารตะกั่วบัดกรีชั่วคราว ขณะที่กรมอนามัยได้ขอความร่วมมือจากผู้ประกอบการร้านก๋วยเตี๋ยวงดใช้หม้อก๋วยเตี๋ยวที่มีสารตะกั่วบัดกรี หันมาใช้ “หม้อก๋วยเตี๋ยวอนามัย” ผลิตโดยกรรมวิธีใช้ก๊าซเฉื่อยเข้ามาเชื่อมโลหะ หรือการเชื่อม “ทิก” (Tungsten Inert Gas Welding) ที่เรียกอีกชื่อหนึ่งว่าเชื่อม “อากอน” ซึ่งอาจจะมีราคาแพงกว่าหม้อก๋วยเตี๋ยวทั่วไปถึง 3 เท่า แต่อายุการใช้งานนานกว่า ที่สำคัญคือช่วยให้ผู้บริโภคปลอดภัยจากพิษของสารตะกั่ว
ล่าสุด เพื่อให้เกิดความปลอดภัยในการใช้ภาชนะที่ผลิตจากเหล็กกล้าไร้สนิม และเพื่อให้ภาชนะและเครื่องใช้ชนิดนี้มีการนำไปใช้อย่างถูกต้องเหมาะสม คณะกรรมการว่าด้วยฉลากสำนักงานคณะกรรมการคุ้มครองผู้บริโภคจึงได้กำหนดให้ภาชนะและเครื่องใช้เหล็กกล้าไร้สนิมสำหรับอาหารเป็นสินค้าที่ควบคุมฉลาก โดยต้องระบุชนิดของเหล็กกล้าไร้สนิมที่ใช้เป็นวัตถุดิบในการผลิตตามมาตรฐาน ผลิตภัณฑ์อุตสาหกรรม มอก.1378 หรือมาตรฐานสากล และกำหนดข้อแนะนำในการใช้พร้อมระบุคำเตือนเพื่อให้ผู้บริโภคนำไปใช้ได้อย่างถูกต้องและมีความปลอดภัย
“ขณะนี้มีภาชนะและสินค้าที่ผลิตจากเหล็กกล้าไร้สนิมลักลอบนำเข้ามาจากต่างประเทศ และมีการนำไปใช้ไม่เหมาะสม เช่น พอนำมาใช้กับอาหาร ประเภทน้ำปลา หรือน้ำส้มสายชู ก็จะเกิดสนิมได้ง่าย และสนิมนั้นอาจปนเปื้อนไปในอาหารได้จึงจำเป็นต้องมีการกำหนดฉลากระบุชนิดของเหล็กกล้าไร้สนิมที่เป็นวัตถุดิบที่นำมาใช้ เพื่อที่ผู้บริโภคจะได้รู้ว่าจะได้เหล็กกล้าไร้สนิมเกรดไหนไปใช้” นายจิรชัย มูลทองโร่ย เลขาธิการ สคบ. บอก
สำหรับรายละเอียดที่ต้องระบุลงไปในฉลาก คือ ต้องระบุชนิดของเหล็กกล้าไร้สนิมที่ใช้เป็นวัตถุดิบในการผลิตตามมาตรฐาน ผลิตภัณฑ์อุตสาหกรรม มอก.1378 หรือมาตรฐานสากล เช่น SST304 SST430 ในกรณีเหล็กกล้าไร้สนิมที่ใช้เป็นวัตถุดิบที่ไม่อยู่ในข้อกำหนดมาตรฐานดังกล่าว ให้ระบุชนิดและร้อยละของส่วนผสมหลักขั้นต่ำ ได้แก่ โครเมียม และนิกเกิล โดยไม่ให้ใช้ตัวย่อและสัญลักษณ์ นอกจากนี้ ยังให้มีการใส่ข้อแนะนำในการใช้ที่ต้องระบุลงไปในฉลากสำหรับชนิดของเหล็กกล้าไร้สนิมที่ใช้เป็นวัตถุดิบตามมาตรฐานผลิตภัณฑ์อุตสาหกรรม มอก.1378 หรือมาตรฐานสากล เช่น ไม่ควรใช้ฝอยเหล็กขัดทำความสะอาด ควรใช้ฟองน้ำในการทำความสะอาดและเช็ดให้แห้งทันทีหลังใช้งาน ถ้าชนิดของเหล็กกล้าไร้สนิมที่ใช้เป็นวัตถุดิบที่ไม่อยู่ในข้อกำหนดมาตรฐานผลิตภัณฑ์อุตสาหกรรมหรือมาตรฐานสากลนั้น ก็จะมีข้อแนะนำในการใช้ที่เหมือนกันกับแบบมาตรฐาน แต่จะมีข้อแนะนำที่เพิ่มเติม คือ ไม่ควรแช่หรือสัมผัสกับกรด เกลือ และด่างเข้มข้น เช่น น้ำปลา น้ำมะนาว และน้ำส้มสายชู
สำคัญที่สุดในส่วนของคำเตือนที่ต้องใส่ลงไปในฉลากต้องมีข้อความว่า “ห้ามใช้กับเตาไมโครเวฟ” โดยต้องใช้ตัวอักษรขนาดใหญ่กว่าตัวอักษรอื่น และสีของข้อความจะต้องตัดกับสีพื้นด้วย
ดังนั้นในการเลือกซื้อภาชนะเหล็กกล้าไร้สนิมหรือสเตนเลส สตีล ผู้บริโภคจึงควรสังเกตฉลากคำเตือน ข้อแนะนำต่างๆให้ครบถ้วน หากไม่พบฉลากหรือคำเตือนดังกล่าวไม่ควรซื้อภาชนะนั้นมาใช้และควรแจ้ง สคบ.ให้ เข้ามาดำเนินการ เนื่องจากการไม่แสดงฉลากหรือข้อแนะนำดังกล่าว มีความผิดตามประกาศคณะกรรมการว่าด้วยฉลาก ฉบับที่ 34 (พ.ศ. 2555) เรื่องให้ภาชนะและเครื่องใช้เหล็กกล้าไร้สนิมสำหรับอาหารเป็นสินค้าที่ควบคุมฉลาก มีบทลงโทษตามกฎหมาย คือ ในกรณีขายสินค้าที่ควบคุมฉลากโดยไม่มีฉลากหรือมีฉลากแต่การแสดงฉลากไม่ถูกต้อง ต้องระวางโทษจำคุกไม่เกิน 6 เดือน หรือปรับไม่เกิน 5 หมื่นบาท หรือทั้งจำทั้งปรับ และถ้ากรณีเป็นการกระทำของผู้ผลิตหรือผู้สั่งหรือผู้นำเข้าจะมีโทษจำคุกไม่เกิน 1 ปี หรือปรับไม่เกิน 1 แสนบาท หรือทั้งจำทั้งปรับ
ซึ่งนอกจากจะเป็นการคุ้มครองผู้บริโภคให้ได้รับความปลอดภัยแล้ว การดำเนินการดังกล่าวยังเป็นการรองรับต่อสินค้าชนิดนี้ในการเข้าสู่ประชาคมเศรษฐกิจอาเซียนในอนาคตด้วย.
 MnO4– +
Bi3+ + H2 O
MnO4– +
Bi3+ + H2 O  MnO4–
MnO4–  Bi3+
Bi3+  MnO4– + 5e– + 8H+
MnO4– + 5e– + 8H+  Bi3+ + 3H2O
Bi3+ + 3H2O MnO4– + 5e– + 8H+ x
2
MnO4– + 5e– + 8H+ x
2 2MnO4– + 10e– + 16H+
2MnO4– + 10e– + 16H+ Bi3+ + 3H2O x 5
Bi3+ + 3H2O x 5 5Bi3+ + 15H2O
5Bi3+ + 15H2O 2MnO4– +
5Bi3+ + 7H2O
2MnO4– +
5Bi3+ + 7H2O